广州安尔诺生物科技有限公司
Guangzhou Anernor Biotechnology Co., Ltd
裸鼠肺转移瘤
裸鼠(无胸腺鼠)肺转移瘤模型是癌症研究中常用的动物模型之一,因其缺乏功能性胸腺而没有有效的免疫系统,不会对植入的外来细胞产生免疫排斥反应。这使其成为研究肿瘤生物学和治疗方法的理想工具。以下是详细的介绍:
建立裸鼠肺转移瘤模型的步骤
1.选择合适的肿瘤细胞系
细胞系选择:选择人类或动物来源的癌细胞系,这些细胞系通常具有高度的转移能力,如肺癌、乳腺癌、黑色素瘤等。
细胞培养:在无菌条件下培养肿瘤细胞,确保其处于对数生长期(生长最快的阶段),以增加实验成功的可能性。
2.接种肿瘤细胞
接种方法:常用的方法包括尾静脉注射、皮下接种或直接注射到目标器官中。
尾静脉注射:将一定数量的肿瘤细胞悬浮液注射到裸鼠的尾静脉中,细胞通过血液循环转移到肺部。
皮下接种:将肿瘤细胞注射到裸鼠的皮下组织,观察其原位生长和后续的转移情况。
器官特异性注射:如需要特定器官的转移瘤,可将细胞直接注射到该器官中,如肝脏或肾脏。
一般根据肿瘤细胞接种方式,主要分为以下几种转移模型:
(1)尾静脉注射
肿瘤细胞经尾静脉注射后,先通过肺部的毛细血管网进入动脉血液循环系统,可造成全身多发转移灶。但是由于肿瘤细胞较为粘稠易聚团,一般会被困在小鼠肺部微血管,主要形成肺转移,可能后期会造成远端器官的转移。主要用于建立肿瘤转移(血行通路)模型或血癌模型或者肿瘤肺转移。
(2)左心室注射
肿瘤细胞经过左心室注射进入小鼠体循环,细胞经过粘附,降解及迁移等过程,最终造成不同器官的转移,可以很好的模拟肿瘤的血道转移过程。一般多造成骨、脑等部位转移。
(3)原位注射
将肿瘤细胞移植于小鼠相应器官,如人乳腺癌细胞移植到裸鼠乳房垫上,人的肝癌移植到裸鼠肝叶上。该模型可模拟转移的全过程,包括最初侵袭组织,穿入血管和形成转移灶等步骤,更加接近人类肿瘤转移的过程。因此原位模型广泛用于抑制肿瘤转移和生长的药物筛选。
(4)腹腔注射
将肿瘤细胞注射到小鼠腹腔,操作简单,可出现一定比例的浸润、转移和腹水。主要是观察肿瘤细胞在腹腔内的转移情况,但是腹腔血液循环相对较少,不利于肿瘤转移的发生,适合某些肿瘤转移过程,如卵巢癌。
(5)其他注射方式
除了上面常见的几种转移模型,还有用到的如:爪垫皮下移植(因爪垫皮下有丰富的淋巴管,可研究淋巴道转移);肾包膜(肾包膜血管丰富,可立即供给移植肿瘤充分的氧及营养);脾脏注射(可造成肝转移模型)等。
3.原位肿瘤生长
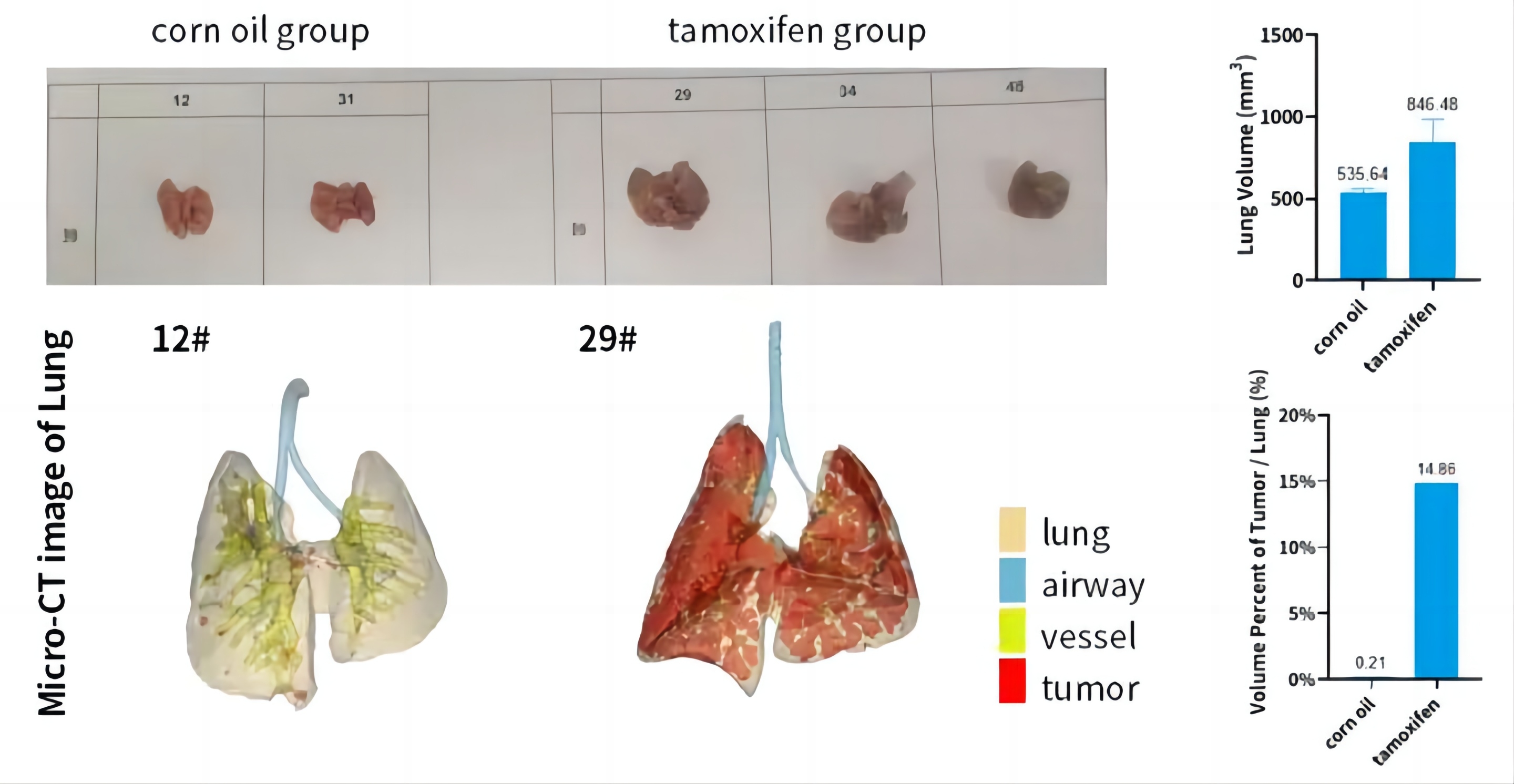
生长监测:使用活体成像技术(如荧光成像、磁共振成像等)定期监测肿瘤在注射部位的生长情况。
健康观察:观察裸鼠的体重、食欲、活动水平等,评估其健康状况。
4.转移过程
自然转移:部分肿瘤细胞会脱离原位肿瘤,通过血液或淋巴系统转移到其他器官,常见的转移部位包括肺、肝、脑等。
转移监测:使用影像学和分子生物学方法监测转移瘤的形成和发展。常用的检测方法包括活体成像、CT扫描、MRI等。
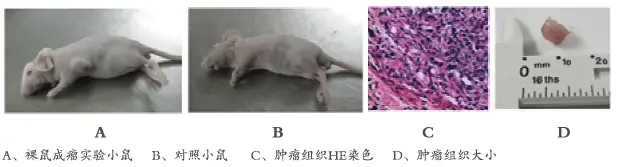
5.肺部转移瘤的评估
解剖和组织学分析:在实验结束时,通过解剖裸鼠并取出肺部组织,进行组织切片和染色(如H&E染色)以观察转移瘤的分布和形态。
免疫组化和分子分析:通过免疫组织化学染色(如Ki-67标记增殖细胞)和PCR、Western Blot等技术,进一步分析转移瘤的分子特征和生物学行为。
6.治疗和干预实验
药物测试:评估新型抗癌药物或治疗方法对肺转移瘤的抑制效果,常用的指标包括肿瘤体积、细胞增殖和凋亡情况等。
基因编辑:利用CRISPR/Cas9等基因编辑技术研究特定基因在转移过程中的作用。
常见PDTX模型展示
广州安尔诺生物科技有限公司
备案号:粤ICP备20031199号
扫一扫,添加技术支持咨询

