广州安尔诺生物科技有限公司
Guangzhou Anernor Biotechnology Co., Ltd
RNA pull-down
实验介绍
【技术原理】
首先标记 RNA(如生物素探针标记 RNA),将其与细胞裂解液共同孵育,形成 RNA-蛋白质复合物,分离复合物得到蛋白质,通过蛋白免疫印迹(western blot)或质谱(massspectrometry)检测蛋白。
【实验方法】
Step1:生物素探针标记RNA的制备
Step2:RNA抽提
Step3:细胞裂解
Step4:磁珠预处理
Step5:RNA与磁珠结合
Step6:RNA 与蛋白相互作用
Step7:蛋白的检测
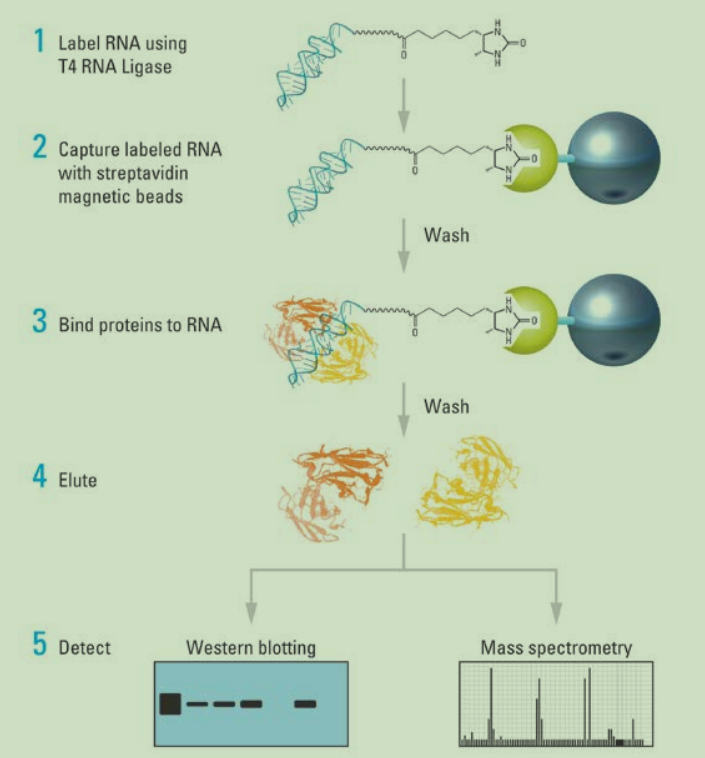
【实验流程】
案例展示

Samples were normalized by volume. L = lysate load; FT = flow-through, E = eluate.
【结果分析】
根据Western blotting检测结果可知带标记的AR 3´-UTR RNA可以特异性的结合HuR蛋白。
技术总结
【常见问题】
1、RNA结合蛋白没有结合
可能原因:(1)靶蛋白量不足;(2)缓冲体系不对;(3)RNA探针和蛋白的亲和力本来就低。
解决方法:(1)增加上样蛋白量;(2)应用低盐体系;(3)加入交联试剂。
2、RNA 降解
可能原因:无核酸酶的环境被破坏,比如RNA提取过程中的试剂及材料等;体外转录的RNA探针降解等。
解决方法:清洗和使用新开的离心管和试剂等;RNA探针合成后,电泳检测其长度和浓度。
3、RNA结合蛋白的亲和力不够
可能原因:结合缓冲环境没有优化、裂解不完全、磁珠用量不足、RNA探针用量不足等。
解决方法:优化孵育时间、温度、盐浓度等条件、增加裂解液和蛋白上样量的比例、适当改变磁珠及探针用量、增加裂解液、确定生物素和链霉亲和素效率等。
4、结合的非特异性高
可能原因:(1)缓冲环境没有优化;(2)缓冲环境严谨性低;(3)样品没有裂解完全和裂解体系没有优化。
解决方法:(1)优化孵育时间温度盐浓度等条件;(2)使用严谨性高的缓冲体系;(3)调低RNA探针和样品的比例;(4)提高裂解液的量。
5. WB信噪比高
可能原因:(1)阳性信号率低;(2)一抗效率低;(3)蛋白没有充分溶解。
解决方法:(1)增加二抗的量;(2)用敏感度的化学发光液;(3)用细胞裂解液预孵一抗;(4)增加样品的量;(5)确定有没有其他可能的结合情况;(6)增加裂解液用量。
【注意事项】
1、RIP反应体系中的试剂和抗体中均需保证无RNase;
2、磁珠与带标签的RNA要充分混合,可优化孵育的温度、时间以及RNA的含量等。
送检与交付标准
| 样品类型 | 样品需求 | 保存条件 | 运输条件 | 备注 |
|---|---|---|---|---|
| 动物组织 | 单个样品>0.1g,2mlEP管或冻存管装,不要过量;样本应尽量新鲜,如不能立即提取蛋白或核酸,应液氮速冻后冻存于-80℃或更低,冻存样本避免反复冻融以致降解 | -80℃ | 干冰 | 所有样本均须有唯一标记,且标记清晰可识 |
| 种子样本 | 去壳新鲜或保存于液氮中的的种子样本,单个样品>0.2g。 | -80℃ | 干冰 | |
| 贴壁/悬浮细胞 |
1. 总RNA或蛋白:106cell/指标、浆/核RNA或蛋白:107cell/指标、线粒体RNA或蛋白:2*107 cell/指标,样本尽量新鲜,细胞收取后直接加Trizol(QPCR检测)或直接冻存于-80℃ 2. 若细胞处理(加药、转染、感染)后状态差应酌情加大收样量 |
-80℃ | 干冰 | |
| 全血/血清样品 | 用抗凝管保存的外周血 5~10ml,骨髓 1~3ml; -80℃保存不超半周的白细胞匀浆>400μl,每 400μl 加入 400μl Trizol。 | -80℃ | 干冰 | |
| 石蜡包埋样品 | 由标准的石蜡包埋盒包埋的石蜡块,有效厚度大于 0.1cm; 新鲜的 FFPE 组织切片,每片厚度不超过 10μm,2~8 张,表面积不超过 250mm2。 | -20℃ | 冰袋 | |
| 抗体 |
1. 按样本种属提供满足相应实验要求的抗体; 2. 按抗体说明书要求寄送,尽量避免分装;如分装,确保量足够进行实验,并提供抗体说明书。 3.保存抗体的抗体管上应有能够识别此抗体的标记,抗体的量应大于实验所需的量。 |
-20℃ | 冰袋 | |
| 引物 | 干粉,≥1OD,如进行预实验,每个基因至少提供两对引物, 附带公司引物合成单。 | -20℃ | 冰袋或常温 |

广州安尔诺生物科技有限公司
备案号:粤ICP备20031199号
扫一扫,添加技术支持咨询

